GIỚI THIỆU CHUNG:
Phương pháp Kendan (Kjeldahl) được sử dụng trong hóa học phân tích để xác định hàm lượng Nitơ trong các mẫu chất hữu cơ hiện được quan tâm rất lớn trong các lĩnh vực quan trọng như thực phẩm, đồ uống, phân bón đất cây trồng, thức ăn chăn nuôi và môi trường ngày nay.
Hàm lượng Protein (đạm) tổng số trong thực phẩm được tạo thành từ hỗn hợp protein phức tạp. Chúng tồn tại trong sự kết hợp với carbohydrate hoặc lipit, có thể là vật lý hoặc hóa học. Hiện tại, tất cả các phương pháp xác định hàm lượng protein tổng số của thực phẩm đều có tính chất thực nghiệm. Một phương pháp tuyệt đối là cô lập và cân trực tiếp protein nhưng phương pháp này chỉ được sử dụng đôi khi trong nghiên cứu sinh hóa, vì nó rất khó và cũng không thực tế lắm.
Năm 1883, nhà nghiên cứu người Đan Mạch Johann Kjeldahl đã phát triển phương pháp được sử dụng nhiều nhất đến nay, để phân tích protein (gọi tắt là phương pháp Kjeldahl) bằng cách xác định nitơ hữu cơ. Trong kỹ thuật này, protein và các thành phần hữu cơ khác của thực phẩm được phân hủy trong hỗn hợp với axit sulfuric khi có mặt chất xúc tác. Nitơ hữu cơ tổng số được chuyển đổi bằng cách phân hủy trong amoni sulfat. Hỗn hợp phân hủy được trung hòa với một bazơ và chưng cất sau đó. Sản phẩm chưng cất được thu nhận trong dung dịch axit boric. Các anion borat tạo thành được chuẩn độ bằng HCl đã được chuẩn hóa (hoặc H2SO4) để xác định hàm lượng nitơ trong mẫu.
Kết quả phân tích là một hàm lượng protein thô gần đúng của mẫu chất thực phẩm vì nitơ cũng đến từ các thành phần phi protein.
Phương pháp Kjeldahl đã trải qua một số sửa đổi. Ban đầu, kali permanganat được sử dụng để thực hiện quá trình oxy hóa (phân hủy); tuy nhiên, kết quả không đạt yêu cầu, do đó thuốc thử đã bị loại bỏ. Năm 1885, Wilforth thấy rằng phân hủy có thể tăng tốc bằng cách sử dụng axit sulfuric và thêm chất xúc tác. Gunning năm 1889 đề xuất bổ sung kali sulfat, làm tăng điểm sôi của axit sulfuric được sử dụng trong quá trình oxy hóa, để giảm thời gian phản ứng.
Ngày nay, đồng sulfate pent hydrated CuSO4.5H2O được sử dụng chủ yếu làm chất xúc tác.
Từ năm 1883, khi John Kjeldahl trình bày phương pháp của mình, phương pháp của ông đã được chấp nhận rộng rãi và được áp dụng trong nhiều lĩnh vực khác nhau để phân tích lương thực, đồ uống, thức ăn, ngũ cốc, thịt, nước thải, đất trồng cây. Ngày nay ,phương pháp của ông được sử dụng rộng rãi nhất để phân tích protein và được thực hiện bằng cách xác định nitơ hữu cơ. Điều này là do các loại protein khác nhau trùng với tất cả trong một tỷ lệ tương tự của nitơ hữu cơ . Trong hầu hết các trường hợp, hệ số tính toán sau được sử dụng:
Hàm lượng protein = hàm lượng nitơ hữu cơ x 6.25
Trong kỹ thuật này, protein và các hợp chất hữu cơ khác trong hỗn hợp thức ăn được phân hủy bằng axit sulfuric khi có mặt chất xúc tác. Tổng nitơ hữu cơ được chuyển thành amoni sulfat thông qua quá trình phân hủy. Hỗn hợp thu được được trung hòa với một bazơ và chưng cất. Sản phẩm chưng cất được thu lại trong dung dịch axit boric. Các anion borat hình thành được chuẩn độ bằng HCL chuẩn hóa để xác định hàm lượng nitơ trong mẫu.
Nhìn chung, phương pháp Kjeldahl có ưu điểm là được thực hiện bởi các thiết bị không phức tạp và có thể được thực hiện bởi các kỹ thuật viên ít kinh nghiệm.
Phương pháp Kjeldahl đã được chính thức công nhận bởi một số lượng lớn các cơ quan chính phủ và các hiệp hội quốc tế như: AOAC , EPA, AACC, AOCS, ISO, USDA và các tổ chức khác.
Phương pháp này bao gồm 3 giai đoạn: DIGESTION - DISTILLATION - TITRATION (Phân hủy – Chưng cất – Chuẩn độ)
Phân hủy là quá trình tách nitơ chứa trong các mẫu hữu cơ bằng cách sử dụng dung dịch axit đậm đặc và được thực hiện bằng cách đun sôi mẫu trong axit sulfuric. Kết quả là một dung dịch amoni sulfat.
Amoniac được giải phóng trong giai đoạn DISTILLATION, được giữ lại trong dung dịch với một lượng axit boric đã biết. Giai đoạn đầu, chưng cất được thực hiện theo phương pháp chưng cất hơi nước truyền thống, việc tăng tốc chưng cất sau đó giúp thu được sản phẩm.
TITRATION được sử dụng cuối cùng ,để cuối cùng đánh giá lượng amoni có trong mẫu chưng cất.
CÁC PHẢN ỨNG THỰC HIỆN THEO PHƯƠNG PHÁP KJELDAHL
PHÂN HỦY/PHÁ MẪU
DIGESTION
catalysts→
(1) n - C -NH2 + mH2SO4 → CO2 + (NH4)2 SO4 + SO2
protein heat→
NEUTRALIZATION AND DISTILLATION
(2) (NH4)2SO4 + 2 NaOH → 2NH3 + Na2SO4+ 2H2O
(3) NH3 + H3BO3 (boric acid) → NH4 + H2BO3- (borate ions)
TITRATION
Các Anion borat (tỷ lệ thuận với hàm lượng nitơ) được chuẩn độ bằng HCl chuẩn hóa (hoặc H2SO4)
(4) H2BO3- + H+ → H3BO3
THỰC NGHIỆM - THIẾT BỊ CHUẨN BỊ
Trong những năm gần đây, các thiết bị mới đang được phát triển và cải tiến công nghệ để thực hiện các kỹ thuật phân tích này.
Hãng JP Selecta, nhận thức được nhu cầu của các phòng thí nghiệm, đã dành một sự đầu tư không hề nhỏ cùng với nỗ lực đáng kể để đưa ra thị trường một loạt thiết bị mới, ngày càng tối ưu, hoàn hảo, để giúp công việc phát triển phương pháp Kjeldahl nâng cao tốc độ, độ chính xác, và kết quả lặp lại chính xác.
Các thiết bị xác định nitơ hữu cơ bao gồm ba bộ thiết bị cơ bản sau:
Gần đây, hệ thống phá mẫu tự động mới, Auto Digest 20, đã được bổ sung, tối ưu hóa thời gian và cho độ tin cậy cao với các phòng thí nghiệm chuyên nghiệp.
Một số điều kiện liên quan, yếu tố cần quan tâm trong quá trình phân hủy, xác định tốc độ phản ứng và phân hủy nitơ thành amoni sunfat, chẳng hạn như lượng nhiệt được truyền, lượng muối để tăng nhiệt độ sôi axit, chất xúc tác được sử dụng và thời gian phân hủy.
Việc điều chỉnh bất kỳ thông số nào trong các yếu tố này đều ảnh hưởng đến phần còn lại. Đã có các nghiên cứu để xác định các thông số cần thiết để đạt được điều kiện tối ưu tùy thuộc vào ma trận mẫu.
Ví dụ, lượng axit cần thiết thay đổi tùy thuộc vào lượng chất béo có trong mẫu. Lượng chất béo càng nhiều thì càng cần nhiều axit hơn. Nó cũng thay đổi theo thời gian phân hủy.Thời gian phân hủy càng dài, càng nhiều axit bị mất do bay hơi. Thời gian phân hủy nên được xác định tùy thuộc vào lượng thu hồi bằng cách sử dụng các mẫu đã biết.
Bổ sung muối để tăng nhiệt độ sôi của H2SO4, việc bổ xung lượng muối là cần thiết để quá trình phá hủy nhanh hơn. Tùy thuộc vào loại muối được sử dụng, nhiệt độ có thể đi từ 330 °C chỉ riêng axit sulfuric, đến 400 °C khi có muối, do đó làm tăng tốc độ phân hủy/phá mẫu và rút ngắn đáng kể thời gian phá hủy.
Để thực hiện phá hủy, thông thương sử dụng khối gia nhiệt làm bằng nhôm và vỏ được bao quanh bởi lớp cách nhiệt dày và được lắp ráp trên khung thép không gỉ. Khối gia nhiệt có các kích thước khối khác nhau cho 6, 12 và 20 mẫu cùng lúc.
Yếu tố gia nhiệt là điện trở nhiệt và được điều khiển bởi một thiết bị điện tử kết hợp bộ vi xử lý cho phép người dùng lựa chọn và ghi nhớ một số chương trình làm việc với phân đoạn nhiệt và thời gian có thể lập trình đầy đủ. Khả năng lập trình như vậy cho phép tối ưu hóa quá trình phân hủy.
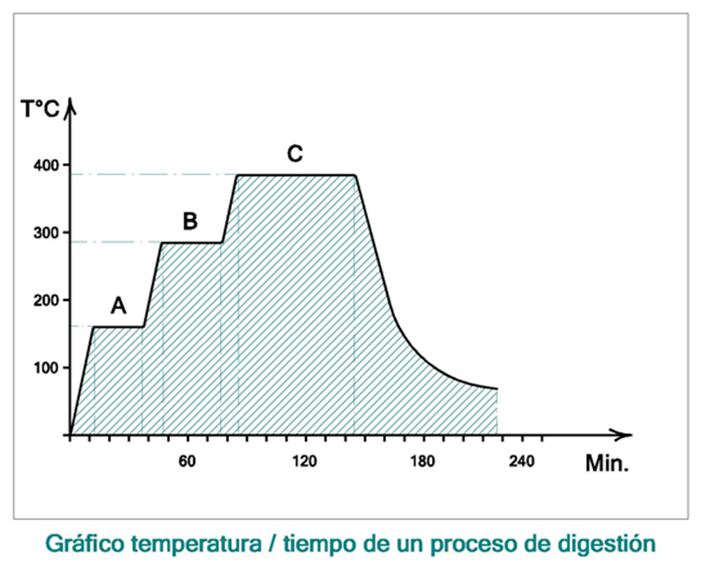
QÚA TRÌNH PHÁ HỦY ĐƯỢC THỰC HIỆN TRONG 3 BƯỚC
1. Tùy thuộc vào hàm lượng nước trong mẫu, bắt đầu quá trình phân hủy bằng cách làm bay hơi nước ở 150 °C trong 15 và 30 phút.
2. Thực hiện bước thứ hai từ 270 đến 300 °C trong khoảng thời gian từ 15 đến 30 phút để giảm lượng khói trắng sinh ra trong quá trình phá hủy
3. Tiếp tục phân hủy ở 400 ºC trong 60 và 90 phút.
Kiểm soát trực quan kết quả: Kết quả là chất lỏng trong suốt có màu xanh nhạt, xanh lục hoặc vàng tùy thuộc vào chất xúc tác được sử dụng. Không còn dư lượng cặn kết tủa bám vào thành ống.
MỘT SỐ VÍ DỤ VỀ CHƯƠNG TRÌNH THƯ VIỆN VỚI MẪU ĐÃ CÓ:
Pho mát hoặc thịt:
Step 1: 150ºC / 30 ’ -> Step 2: 270ºC / 30’ -> Step 3: 400ºC / 90 ’
Ngũ cốc:
Step 1: 150ºC / 15 ’ -> Step 2: 300ºC / 15’ -> Step 3: 400ºC / 60 ’
Các thiết bị của J.P. SELECTA phù hợp nhất cho quy trình phân tích PHÁ MẪU MODEL "BLOC-DIGEST"
o Kiểm soát nhiệt độ độc lập.
o Kết nối RS-232 trực tiếp hai chiều cho phép chuyển tải thông tin dữ liệu chương trình ghi nhiệt độ của khối gia nhiệt với chương trình ghi và cổng kết nối RAT với máy tính.
o Đĩa CD phần mềm được cung cấp kèm theo bộ phá mẫu. Phần mềm này tạo điều kiện cho phép chỉnh sửa các chương trình chỉnh phân hủy và cho phép bạn theo dõi và ghi lại nhiệt độ của bộ phá hủy mẫu
o Xử lý mẫu ít hơn.
o Khối gia nhiệt bằng nhôm nâng cao khả năng đồng đều khi gia nhiệt.
o Phạm vi nhiệt độ từ 45 đến 450 °C.
o Bộ nhớ được lập trình ghi tới 20 chương trình nhiệt, với 4 bước phân đoạn.
o Thời gian tối đa mỗi bước: 600 phút.
o Chỉ thị âm thanh khi kết thúc chương trình phá mẫu.
o Hai gradient nhiệt độ có thể lựa chọn: Kjeldahl / D.Q.O.
o Cảnh báo khi cảm biến đường nhiệt bị đứt gãy.
HỆ THỐNG CHIẾT TÁCH VÀ TRUNG HÒA KHÍ ĐỘC
Hệ thống được thiết kế đặc biệt để hấp thụ và trung hòa các khí axit tạo ra trong quá trình phá mẫu Kjeldahl.
Bao gồm bộ lọc hút trung hòa axit ngưng tụ và bơm tuần hoàn nước tạo thể tích chân không lớn cho việc hút khí độc.
BỘ PHÁ MẪU HOÀN TOÀN TỰ ĐỘNG 20 VỊ TRÍ ,MODEL AUTO DIGEST 20
Thiết bị thực hiện quá trình phá mẫu hoàn toàn tự động, với giá đỡ mẫu thiết kế tự động nâng lên và hạ xuống.
Thiết bị có cấu trúc kim loại và vỏ ngoài của giá giữ mẫu tự động được phủ epoxy. Giá đỡ ống phá mẫu được làm bằng một vật liệu đặc biệt chống ăn mòn hóa học axit.
Đặc điểm:
o Thao tác mẫu tự động.
o Nhiệt độ đồng nhất.
o Điều khiển điều khiển tự động cho tối đa 20 chương trình về nhiệt độ, thời gian và độ cao của mẫu sau khi phân hủy và chạy / dừng hút khí độc.
o Cổng RS-232 kết nối bộ ghi nhiệt độ và chương chình phá hủy từ máy tính.
o Hệ thống hấp thụ khí độc mà không cần sử dụng tủ hút ngoài.
o 1 khối gia nhiệt bằng kim loại gồm 20 vị trí.
o 1 hệ thống nâng tự động cho mẫu.
o 1 Lập trình điều khiển “Rat-2” cho các quy trình thời gian / nhiệt độ.
o 1 giá đỡ ống phá mẫu
o 1 bộ thu khí
o bộ ống phá mẫu 20 ống * 250ml
Sản phẩm sau khi phá hủy thường được pha loãng với nước không có amoniac để giảm thiểu tác động của hỗn hợp có chứa tỷ lệ axit / muối cao.
Phần lớn NH3 được chưng cất và giữ lại trong dung dịch axit trong 5 đến 10 phút đun sôi đầu tiên, nhưng tùy thuộc vào thể tích hỗn hợp phá hủy và phương pháp tiếp theo, với thể tích ngưng tụ từ 20 đến 140ml thu được thì có thể thu được lượng nitơ hoàn chỉnh trong mẫu phá.
Đôi khi việc chưng cất được yêu cầu phải thu được lớn hơn, tạo ra nhiều nước hơn, tuy nhiên điều này không làm thay đổi kết quả khi thực hiện chuẩn độ.
Tốc độ chưng cất nhanh chậm phụ thuộc vào công suất làm lạnh ngưng tụ và khả năng sinh nhiệt từ bộ phận gia nhiệt.
Hệ thống gia nhiệt bằng hơi nước tăng tốc để thực hiện việc chưng cất.
Sử dụng dung dịch axit Boric đã biết liều lượng, không nhất thiết phải cần độ chính xác cao, khi chuẩn độ cần đo chính xác lượng amoniac bằng cách trung hòa 1:1 phức hợp được hình thành bởi amoniac và axit boric. Trong thực tế, axit boric có thể được thêm vào để đảm bảo sự hấp thu hoàn toàn của amoniac.
Dung dịch thu được phải duy trì ở 45 °C để tránh mất amoniac.
Các thiết bị của J.P. SELECTA phù hợp nhất cho quy trình chưng cất với các phòng thí nghiệm có quy mô nhỏ, trung bình khối lượng phân tích mẫu không nhiều là: PRONITRO “M” và PRONITRO “S”.
Pronitro M với mức độ tự động hóa phù hợp, cung cấp hoạt động đơn giản và an toàn. Nó phù hợp cho phòng thí nghiệm phân tích với khối lượng mẫu nhỏ hoặc trung bình
o Thiết bị chưng cất hơi nước.
o Máy tạo hơi nước nhỏ gọn với công tắc áp suất bảo vệ an toàn quá nhiệt và quá áp suất.
o Cửa an toàn, dừng chưng cất khi cửa mở.
o Phát hiện sự hiện diện của ống phân hủy / chưng cất. Thiết bị này dừng định lượng NaOH nếu không có ống.
o Bộ kết hợp chung cho ống phân hủy / chưng cất MACRO (Ø 42 mm) và MICRO (Ø 26 mm).
o Các bể chứa H2O và NaOH được đặt bên trong thiết bị, giúp tiết kiệm không gian trong phòng thí nghiệm.
o Vỏ bằng thép không gỉ và mặt trước bằng nhựa ABS.
o Bộ kít chuẩn độ tự động.
o Khoảng đo: từ 0,2 đến 200 mg nitơ .
o Thời gian chưng cất có thể lập trình.
o Thu hồi nitơ: > 99,5%
o Tốc độ chưng cất: từ 35 đến 40 ml / phút.
o Thời gian chưng cất điển hình: từ 7 đến 10 phút.
o Tỷ lệ tiêu thụ nước: từ 80 đến 100 lít / h.
o Tiêu thụ nước từ máy tạo hơi nước: 2,5 lít / h.
o Dung tích bể chứa nước cho máy tạo hơi nước: 6 lít.
o Dung tích bể chứa NaOH: 2 lít.
Axit Boric bẫy (bắt) khí amoniac và tạo thành một phức hợp amoniac boric. Khi amoniac bị bắt, màu của dung dịch nhận thay đổi. Tiến hành quy trình như sau:
Chuẩn độ chưng cất bằng HCl hoặc H2SO4 cho đến khi thay đổi màu (Điểm kết thúc: pH 4,65)
Phân tử gam HCL = phân tử gam NH3 = phân tử gam N trong mẫu
Phân tử gam H2S04 = 2 phân tử gam NH3 = 2 phân tử gam N trong mẫu
Trên thực tế, các chỉ số khác nhau có thể được sử dụng để có được một hệ số điểm rẽ sạch sẽ và sắc nét nhất có thể.
Nếu khó phát hiện điểm chuyển, có thể hữu ích khi sử dụng dung dịch trắng để tham chiếu
Khi thực hiện tính toán, chúng ta phải tính đến dung dịch nhận được và các yếu tố pha loãng được sử dụng trong quá trình chưng cất. Tài liệu tham khảo có thể được sử dụng với các phương pháp tham chiếu đã xuất bản.
Thực hiện phép tính:
mg N = N x V x 14
Trong đó:
N = Axit chuẩn độ.
V = Lượng axit tiêu thụ.
14 = Trọng lượng nguyên tử.
• Để chuyển sang hàm lượng protein phù hợp, thì sửa nó theo tham số thích hợp tùy theo tính chất của mẫu (mặc định là 6.25)
• Định kỳ thực hiện một phép thử test mẫu trắng và trừ nó khỏi kết quả.
% Proteins = P2/P0 x 100 x F
Trong đó:
P2: Nitơ (mg).
P0: Trọng lượng mẫu (mg).
F: Tham số protein.
(tham số mặc định là 6.25)
MÁY CHƯNG CẤT VÀ CHUẨN ĐỘ TỰ ĐỘNG HOÀN TOÀN
*Model:PRO-NITRO “A”
Đây là hệ thống hoàn toàn tự động, tích hợp hệ thống chuẩn độ "on-line" (chuẩn độ theo thời gian thực). Thiết bị phân tích có tính hệ thống, độ chính xác cao và không mất nhiều nguồn lực người thực hiện, dễ dàng làm việc và an toàn. Thích hợp cho phòng thí nghiệm phân tích với khối lượng mẫu trung bình hoặc lớn.
PRO-NITRO “A” thực hiện việc chưng cất và chuẩn độ tự động theo thời gian thực, do đó giúp rút ngắn thời gian thực hiện phân tích.
Thiết bị tích hợp loại chuẩn độ này cung cấp một lợi thế bổ sung: nó phát hiện điểm mà tại đó mẫu không còn tạo ra Nitơ, tính chất này được sử dụng để dừng chưng cất vào đúng thời điểm và do đó đảm bảo rằng thời gian chưng cất luôn tối ưu cho việc thu hồi nitơ tối đa và việc kéo dài chưng cất không còn cần thiết nữa.
Phép đo màu sắc (so màu) được chấp nhận bởi AOAC và không cần hiệu chuẩn định kỳ.
o Thiết bị chưng cất hơi nước.
o Tự động «On-line» đánh giá màu sắc.
o Máy tạo hơi nước với công tắc áp suất bảo vệ an toàn nhiệt độ quá nhiệt và bảo vệ quá áp.
o Cửa an toàn ngăn/ ngừng chưng cất nếu cửa mở.
o Phát hiện sự hiện diện của ống chưng cất / phá hủy. Thiết bị này dừng định lượng NaOH nếu không có ống.
o Bộ kết hợp chung cho ống phân hủy / chưng cất MACRO (Ø 42 mm) và MICRO (Ø 26 mm).
o H2O và NaOH, axit boric và HCl được đặt bên trong thiết bị, giúp tiết kiệm không gian trong phòng thí nghiệm.
o Hệ thống thoát nước của ống phân hủy / chưng cất và được thu.
o Dừng chưng cất tự động.
o Màn hình LCD lớn 20 x 4 ký tự.
o Đầu ra RS-232 để in kết quả.
o Vỏ bằng thép không gỉ và mặt trước bằng nhựa ABS.
o Khoảng đo: từ 0,2 đến 200 mg nitơ.
o Tỷ lệ thu hồi nitơ:> 99,5%.
o Tốc độ chưng cất: từ 35 đến 40 ml / phút.
o Tỷ lệ tiêu thụ nước: từ 80 đến 100 lít / h.
o Tiêu thụ nước của máy tạo hơi nước: 2,5 lít / h.
o Dung tích bể chứa nước cho máy tạo hơi nước: 6 lít.
o Dung tích bể chứa NaOH: 2 lít.
o Dung tích bể chứa axit Boric: 2 lít.
o Dung tích bể chuẩn độ: 2 lít.
o Độ chính xác của chuẩn độ: 1,5%.
o Liều lượng tối thiểu của chuẩn độ: 0,01 ml.
XÁC ĐỊNH PROTEIN TỔNG BẰNG PHƯƠNG PHÁP KJELDAHL
1.Nguyên lý:
Phương pháp này bao gồm việc khoáng hóa mẫu bằng axit sulfuric đậm đặc và kiềm hóa bằng natri hydroxit. Việc giải phóng amoniac được thực hiện bằng cách chưng cất và thu lại trên axit boric. Tiếp theo chuẩn độ với axit clohydric cho phép tính hàm lượng protein ban đầu có trong mẫu.
2. Thuốc thử cần thiết:
o Axit sulfuric 96% (d = 1,84).
o NaOH, dung dịch 35% (w / v).
o Chỉ thị hỗn hợp, đặc biệt đối với chuẩn độ amoniac.
o Chất xúc tác Kjeldahl.
o Axit boric 4% (w / v).
o HCl 0,25N
o Nước cất.
o Đá bọt dạng hạt.
Lưu ý: Điều quan trọng là tất cả các thuốc thử hoàn toàn không có nitơ.
3. Trang thiết bị cần thiết:
o Cân phân tích, độ phân giải 0,1 mg
o Digestor (Bloc-Digest).
o Lập trình quy trình RAT.
o Tủ/ quạt hút khí độc
o Pro-Nitro “M” hoặc Pro-Nitro “A”
o Burette để chuẩn độ.
4. Phá mẫu:
o Cân khoảng 1 gram mẫu hoàn toàn được xay nhỏ và được đồng nhất trong giấy không chứa nitơ và cho vào ống phân hủy.
o Thêm 10 g chất xúc tác Kjeldahl, 25 ml axit sulfuric 96% (d = 1,84) và một số hạt đá bọt đã được xử lý vào ống mẫu.
o Đặt các ống phân hủy với các mẫu vào trong khối phân hủy, đặt trong tủ hút khí độc.
o Phân hủy/phá mẫu có thể được thực hiện ở nhiệt độ giữa 350 ~ 420 °C và tại thời gian thực hiện có thể mất từ 1 đến 2h.
o Cuối cùng, chất lỏng thu được là màu xanh lá cây trong suốt hoặc màu xanh tùy thuộc vào chất xúc tác được sử dụng.
o Để mẫu nguội xuống nhiệt độ phòng.
o Tránh kết tủa bằng cách thỉnh thoảng khuấy, lắc.
o Thực hiện thao tác chậm đưa liều lượng 50 ml nước cất cho vào trong mỗi ống mẫu (cẩn thận do phản ứng mạnh).
o Để mẫu nguội xuống nhiệt độ phòng.
o Nếu kết tủa xảy ra, hãy khuấy nhẹ hoặc gia nhiệt.
5. Chưng cất
Định lượng 50 ml axit boric trong bình Erlenmeyer và một vài giọt chỉ thị hỗn hợp. Lưu ý, bình Erlenmeyer phải được ngâm trong axit boric.
Khi ống mẫu và bình Erlenmeyer có axit boric được đặt, định lượng 50ml NaOH và bắt đầu chưng cất.
Chưng cất nên được kéo dài đủ lâu để chưng cất ít nhất 150 ml, khoảng từ 5 đến 10 phút.
6. Test mẫu trắng
Sau khi chưng cất mẫu, thực hiện phép thử trắng bằng cách sử dụng phương pháp được mô tả ở trên, nhưng sử dụng 5 ml nước cất.
7. Chuẩn độ
Chuẩn độ dung dịch chưng cất thu được bằng axit clohydric 0,25N cho đến khi dung dịch chuyển từ màu xanh sang màu tím.
-Tính toán lượng nitơ có mặt:
% Nitrogen = 14 x (V1-V0) x N / P
% Protein =% Nitơ x F
P = Trọng lượng mẫu (g)
V1 = Thể tích HCl được tiêu thụ bởi chuẩn độ (ml)
N = HCl
V0 = Thể tích HCl được tiêu thụ bằng chuẩn độ mẫu trắng (ml)
F = Hệ số chuyển đổi chuyển từ hàm lượng nitơ sang hàm lượng protein. Đối với protein thô, giá trị của 6,25 thường được sử dụng. Để có độ chính xác cao hơn, các hệ số chuyển đổi khác có thể được sử dụng bằng cách phân biệt chất lượng protein theo tính chất mẫu.
Performed by Center of Research and Development -R&D (An Hòa Co.,Ltd)
Reference source J.P Selecta S.A
















addirty
Shalype
Advarne
Noikity